| Klimatfakta.info |
2022-03-30
Vätgas
Vätgas består av två väteatomer. Kemiska beteckningen H2. Den är lukt-, färg- och smaklös. Mycket lättantändlig. Vätgas är ingen naturlig energikälla. Vätgasens har lågt energiinnehåll. Stora förluster vid lagring och distribution.
⇑ Lättantändlig gas
Publ 2022-03-30
 Väte
Väte
Vätgas består av två väteatomer och har den kemiska beteckningen H2. Det är lukt-, färg- och smaklös men mycket lättantändlig gas. Vid låg temperatur/högt tryck förekommer vätgas som vätska. Vid normalt tryck är vätgas flytande mellan -259 °C och -253 °C. Det är då mindre utrymmeskrävande.
Vätgas är lätt brännbart. Tillsammans med syre bildas den explosiva knallgas. När gasblandningen antänds blir restprodukten vattenånga och en del andra ämnen, främst kväveföreningar. När vätgas används i en bränslecell avges endast vatten.
Vätgas är ingen naturlig energikälla, Det finns inga större naturliga förekomster. Vätgas kan produceras för att lagra energi som kan användas i till exempel en bilmotor.
Vätgasens har lågt energiinnehåll per volymenhet (ca en tredjedel jämfört med biogas) vilket ger upphov till stora förluster vid lagring och distribution. Gasen har höga och kostnadskrävande materialkrav vid lagring, distribution och användning av vätgasen, Den är lättantändlig, har ett stort brännbarhetsområde i luft och brinner med osynlig låga vilket är olämpligt ur olycksrisk- och säkerhetssynpunkt.
Det går åt cirka 50-55 kWh för att producera ett kilo vätgas med elektrolys, som i sin tur ger 33 kWh elenergi. Det är en energiförlust på 34%. När vätgasen omvandlas till el med en bränslecell är verkningsgraden 70% (se nedan).
Industriellt produceras vätgas genom sönderdelning av kolväten, oftast genom sönderdelning av naturgas med vattenånga och en nickelkatalysator vid 800 °C. Kolmonoxiden som bildas kan också användas för att tillverka vätgas tillsammans med vattenånga över en järnoxidkatalysator.
Vätgas avger inte koldioxid vid förbränning men däremot kan koldioxid avges till tillverkningen av vätgasen. Stålproduktionen tillverkas med hjälp av kolkoks och står för 6,5% av alla utsläpp av koldioxid i Sverige. Projektet Hybrit syftar till att ersätta kolet med vätgas.
Se även Grönt stål, Klimatfakta.info
⇑ Bränslecell
Publ 2022-03-25
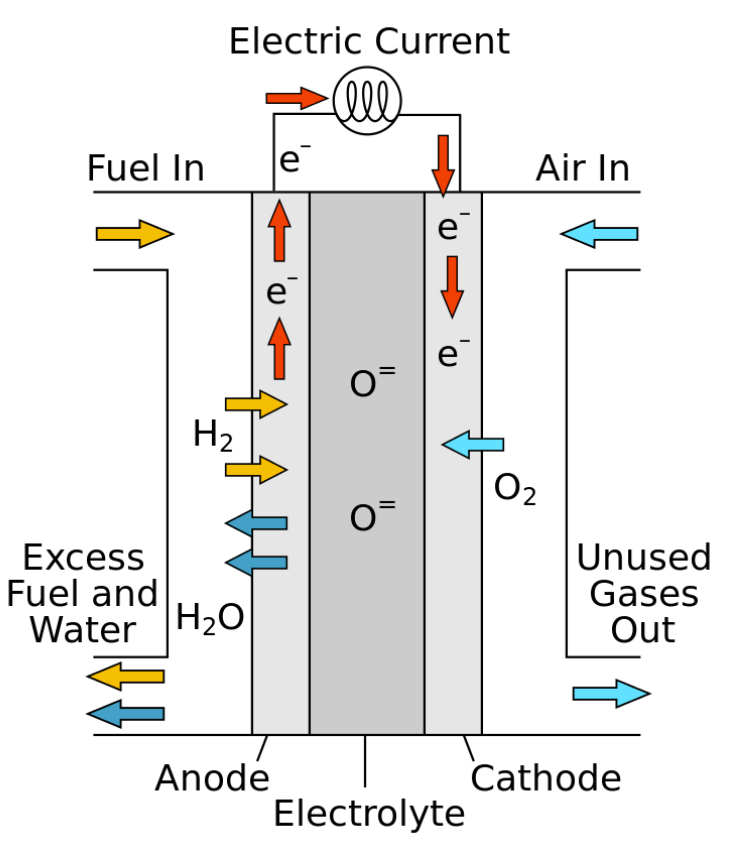 Bränslecell (med som elektrolyt en keramisk oxid), Wikipedia
Bränslecell (med som elektrolyt en keramisk oxid), Wikipedia
En bränslecell omvandlar kemisk energi från ett bränsle plus ett oxidationsmedel till elektricitet, genom en kemisk reaktion varvid bränslet oxideras vid anoden och oxidationsmedlet reduceras vid katoden.
Bränslecellen består av en elektrolyt (ämne som kan leda ström eftersom det innehåller joner som är små laddade partiklar) mellan två elektroder, katoden, som är positiv, och anoden, som är negativ. Bränslet och oxidationsmedlet tillförs elektroderna utifrån och lagras inte inne i cellen som i ett konventionellt primär- eller sekundärbatteri. Ett flödesbatteri kan sägas vara en bränslecell som är uppladdningsbar.
Vanligt är att använda vätgas som förs till anod, och syre till katod men det finns andra koncept som använder andra bränslen och oxidationsmedel. En katalysator splittrar väteatomerna till protoner och elektroner. Medan protonerna kan passera elektrolyten måste elektronerna gå via en yttre krets vilket ger elektrisk ström. Vid katoden bildar en annan katalysator ånga genom att syret, elektronerna och protonerna förenas. I den vidstående bilden är elektrolyten en fastoxid (keramisk oxid) där den inre strömmen förmedlas av syrejoner och vatten(ånga) bildas vid anoden.
Så länge bränslecellen har tillgång till syre och vätgas kan den producera elektricitet. En väte-syrecell ger en spänning på cirka en volt. Bränsleceller seriekopplas för att ge högre spänning som tillsammans med storleken på cellens area kan ge högre strömstyrka, tillsammans mer effekt än en enskild cell.
Då bränslet direkt omvandlas till elektricitet har bränslecellen en högre verkningsgrad, 70 %, jämfört med förbränningsmotorns 30%, då förbränningsmotorn begränsas av carnotverkningsgraden. Om man även tar vara på den värme cellen avger kan verkningsgraden nå 90 %. Den kemiska reaktionen i bränslecellen sker enklare vid högre temperaturer och man kan då använda billigare ämnen som katalysator, exempelvis nickel istället för platina.
För- och nackdelar med bränslecellstekniken
- Hög verkningsgrad.
- Obefintliga avgaser, endast utsläpp av vatten.
- Bränslecellens miljöpåverkan bestäms av hur vätgasen tillverkas. Vätgas kan tillverkas på flera sätt och om den sker på ett hållbart sätt, till exempel genom elektrolys av vatten med hjälp av sol, vind eller kärnkraft, ger bränslecellerna en mycket liten miljöpåverkan. Tillverkning av vätgas ur fossila bränslen som naturgas medför negativ miljöpåverkan. 2019 tillverkades 98 % av allt vätgas av naturgas.
- Än så länge outvecklad distribution av vätgas.
- Komplex styrning av till exempel temperatur, bränsle-, luft- och vattenflöden.
- Frågetecken kring livslängd.
- Dyrt.
⇑ Källor
Publ 2023-04-09
- Vätgas, Wikipedia
- Vätgas, Sverige
- Hydrogen: The Once And Future Fuel, GWPF
- Bränsleceller, Wikipedia
- Nordstream, Wikipedia
- 15 frågor och svar om vätgas: "Stora förväntningar", Ny teknik (2021-01-29)
- Framställning av vätgas, My fuel cell (2015)
- Enorm satsning på vätgas - bygger för 25 miljarder, SvD (2022-04-22)
- Råvaruillusionen: Iridium. Johannes Hjemgaard, Klimatupplysningen (2022-05-30)
- DEBATT: Vätgas är inte lösningen på vindkraftens problem, Fredrik Lundell (M), Bulletin (2022-04-13)
- Grön vätgas på nytt sätt KTH (2021-02-08)
- The truth about hydrogen, DW, Youtube
- El till Gas - System, ekonomi och teknik, Svenskt gastekniskt centrum, pdf (2013)
- Vätgasbubblan kommer att spricka, Jan Blomgren, Magnus Henrekson och Christian Sandström, Kvartal (2022-12-07)
- Power-to-gas, Wikipedia
- Is green hydrogen the answer to the climate crisis? | DW Documentary, Youtube (2021)
- Hydrogen Will Not Save Us. Here?s Why. Sabine Hossenfelder (2023-01-14)
- Vätgas Pågående uppdrag och satsningar, Energimyndigheten
- EU rules for renewable hydrogen: Delegated regulations on a methodology for renewable fuels of non-biological origin EN, EU-parlamentet (2023-04-05)
- The role of hydrogen in achieving Net Zero, Fourth Report of Session 2022-23, House of Commons Science and Technology Committee, UK
Mer att läsa
BränslecellVätgas (2022-03-30)
Nordstream
Vätgas (2022-03-30)
Stål
Koldioxidtull på import till EU - CBAM (2025-12-30)
Konkurrensen i stålkriget (2024-05-05)
Grönt stål (2022-12-25)
Vätgas (2022-03-30)
Vätgas
Koldioxidtull på import till EU - CBAM (2025-12-30)
Vätgas (2025-08-02)
EUs OREALISTISKA SATSNING PÅ VÄTGAS (2024-08-02)
Konkurrensen i stålkriget (2024-05-05)
Christian Sandström (2024-03-15)
Klimatmarknaden (2023-04-11)
Bilism (2023-03-29)
Grönt stål (2022-12-25)
Fordon (2022-12-15)
Naturgas (2022-11-25)
Elektrobränsle (2022-04-26)
Vätgas (2022-03-30)
BMW kommer med vätgasbil (2021-06-17)
Test av vätgaslager i Luleå (2021-06-17)
Biogas (2021-05-26)
klimatfakta
Adm: Hans Iwan Bratt, hibratt@gmail.se | 241012