| Klimatfakta.info |
2022-06-11
Foton
Foton är det elektromagnetiska fältets energikvantum, den minsta energimängd som kan överföras av elektromagnetisk strålning.
⇑ Bakgrund
Publ 2022-06-10
Teorin att elektromagnetisk strålning, som till exempel synligt ljus, inte bara kan betraktas som elektromagnetiska vågor, utan även kan beskrivas som uppdelad i energikvanta, som små energipaket, beskrevs 1905 av Albert Einstein. I en serie experiment kunde man påvisa dessa kvanta, och att de kunde beskrivas som elementarpartiklar med rörelsemängd. År 1926 gavs denna partikel namnet foton.
⇑ Elektromagnetisk strålning
Publ 2022-06-10
Elektromagnetisk strålning har enligt kvantteorin såväl våg- som partikelegenskaper. Det innebär att elektromagnetisk strålning och materia (små objekt som elementarpartiklar, atomer och molekyler) har både våg- och partikelegenskaper. Denna dualitet behandlas inom kvantmekaniken.
Fotonen beskrivs ibland därför som ett vågpaket. Fotonen är också en elementarpartikel och är bärare av den elektromagnetiska växelverkan.
⇑ Bohr atommodell
Publ 2022-06-10
Enligt Max Planck lag för svartkroppsstrålning antog han att ljuset bestod av små energipaket, sk kvanta med en energi motsvarande ljusets frekvensen enligt E=h*f, där E är energi, h är Plancks konstant h = 6,62607015·10-34 Js, där Js = Joulesekunder. Ljuset utbreder sig med ljushastigheten c=f*v. där c = ljusets hastighet, f = frekvensen, v = väglängden. Det ger E=h*c/v, dvs energin är Plancks konstant * frekvensen / väglängden.
Planks kvanta fick 1926 namnet Foton.
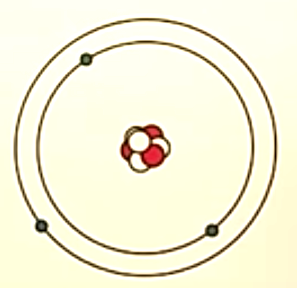 Bohrs atommodell
Bohrs atommodell
Varje grundämne har en egen uppsättning av våglängder och sänder ut fotoner som motsvarar dess våglängder. När atomen sänder ut en foton förlorar den motsvarande energimängd. Atomen har ett därmed ett energitillstånd för varje våglängd.
Elektronerna i en atom kan bara befinna sig på bestämda avstånd från atomkärnan där varje bana motsvarar ett tillåtet energitillstånd. Om elektronen mottar eller avger energi byter den bana som motsvara energimängden.
När en atom mottar en foton tillförs den energi som lyfter en elektron till en yttre bana motsvarande energimängden. Fotonen måste ha exakt den energimängd som motsvarar avståndet mellan två banor för att elektronen ska byta bana. Atomens mottagande av en foton kallas för excitation.
Atomen strävar efter att återgå till sitt normala energitillstånd genom att sända ut en foton vilket innebär att elektroner återförs till sin normala bana. Den utsända fotonens energimängd motsvara skillnaden i energi mellan banorna. Den utsända fotonens "ljus" visas i spektrallinjer. Det kallas för deexitation.
Om den energi som fotonen tillför atomen är större än den yttersta banan frigörs en elektron från atomkärnan.
⇑ Källor
Publ 2022-06-10
- Foton, Wikipedia
- Elektromagnetism. Wikipedia
- 3.1 Bohrs modell för väteatomen, JohanMattefysik
- Hur lång är en foton?, FoF
- Fysik 2 Ljus - en ström av partiklar, Tomas Rönnåbakk Sverin, Youtube
- Tomas Rönnåbakk Sverin
- Matematiska symbollista, rt
Mer att läsa
Bohrs lagFoton (2022-06-11)
Foton
Strålning (2022-08-21)
Foton (2022-06-11)
Kvanta
Foton (2022-06-11)
Strålning
Klimatförändring (2023-08-05)
Växthusgaser (2023-01-09)
Strålning (2022-08-21)
Upparbetning av kärnkraftsbränsle (2022-08-21)
Foton (2022-06-11)
Jordens strålningsbalans (2021-08-15)
klimatfakta
Adm: Hans Iwan Bratt, hibratt@gmail.se | 241012